浙江微流纳米生物技术有限公司
脂质体的主动载药技术
目前常用的主动载药技术主要有pH 值梯度法、硫酸铵梯度法、葡萄糖酸铜梯度法、蔗糖八硫酸酯三乙胺盐梯度法和醋酸钙梯度法等。
1、PH梯度法
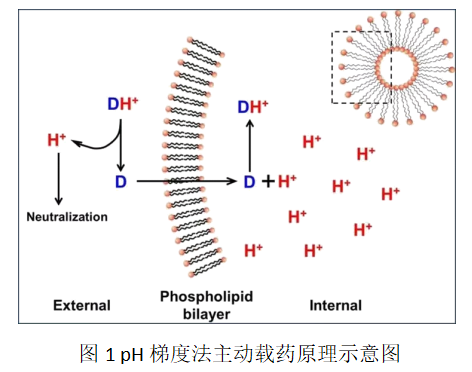
pH梯度法(pH gradient method)是通过调节脂质体内水相和外水相的酸碱性,在脂质膜内外侧建立足够的pH跨膜梯度差,利用弱酸或弱碱性药物在不同pH环境中解离状态的差异,使药物在外水相中以分子形式跨越双分子磷脂膜,在内水相中以离子形式被包封在脂质膜空腔中。pH梯度法是在19世纪80年代由加拿大学者发明,通过实验发现阿霉素等生物碱类药物由于pH值梯度的存在,可以实现药物的主动转运,特异性的向脂质体内聚集。该过程需要首先根据药物的性质选择合适的内水相缓冲液和外水相缓冲液,这决定着药物在储存期间的稳定性以及药物在体内的释放行为;然后以内水相缓冲液水化制备空白脂质体,粒径控制合格后使用交叉流透析、柱层析以及调整pH值等手段置换成脂质体的外相,在脂质体的磷脂膜两侧形成pH梯度;较后在适宜的温度下,磷脂双分子层由排列有序的“胶晶态”(Gel crystalline phase)向无序的“液晶态”(Liquid crystalline phase)过渡,磷脂脂肪链中的“全反式构象”碳-碳单键转换为“邻位交叉式构象”,使脂肪链转动半径大幅增加,导致脂质体膜流动性与通透性增大,从而在跨膜梯度的驱动力下分子型药物渗透穿过磷脂双分子层,将高极性的离子型药物稳定包封于脂质体的内水相中。
2、硫酸铵梯度法
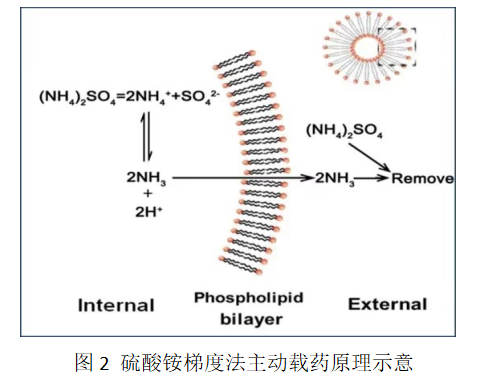
硫酸铵梯度法(Ammonium sulfate gradient method)是pH梯度法的一种发展形式,在20世纪90年代初期由以色列学者发明,适用于主动包载弱碱性药物。该方法的制备过程和传统的pH值梯度法有相似之处。在制备过程中,首先使用硫酸铵缓冲液制备空白脂质体,之后采用交叉流透析等手段除去脂质体外水相中的硫酸铵,在磷脂膜内外侧形成硫酸铵梯度,药物在加热孵育的条件下自动完成跨膜包载。包载的过程中内水相中的NH4+易分解成NH3和H+,NH3易透过磷脂双分子层溢出,而H+则被滞留在内水相中,因此内水相中的pH不断下降,形成酸性环境。分子态弱碱性药物进入内水相之后离子化,并与SO42-形成盐,跨膜能力降低,溶解度也降低,因此药物以沉淀或者胶状形式存在于脂质体内部。硫酸铵梯度法的作用机理较复杂,目前认为主要有两种机制:化学平衡驱动和扩散电势驱动。化学平衡驱动的理论认为,由于硫酸铵电离和水解产生的分子及离子对磷脂双分子层的渗透系数不同,H+的渗透系数较小,而NH3具备较大的渗透系数,因此,NH3能快速扩散至外水相,而H+几乎不能通过磷脂双分子层而被滞留在内水相。外水相中的NH3在载药孵育过程以气体形式挥发而使外水相中的浓度降低,促使内水相的NH3不断外溢和H+逐渐累积,间接形成“内酸外碱”的pH 梯度。当弱碱性药物进入脂质体内水相后,药物离子化消化大量的H+,促使内水相pH升高,导致更多NH3外溢,不断推动药物载入脂质体,直至脂质体内水相NH4+耗竭。扩散电势驱动认为,随着孵育过程内水相中NH3的快速溢出,H+也会产生向外水相扩散的趋势,形成“内正外负”的跨膜扩散电势,驱动弱碱性药物跨膜并聚集在内水相。以硫酸铵梯度法为基础,又以同样的原理发展了蔗糖八硫酸酯三乙胺梯度法、葡萄糖酸铜梯度法、NH4EDTA梯度法等。
3、醋酸钙梯度法
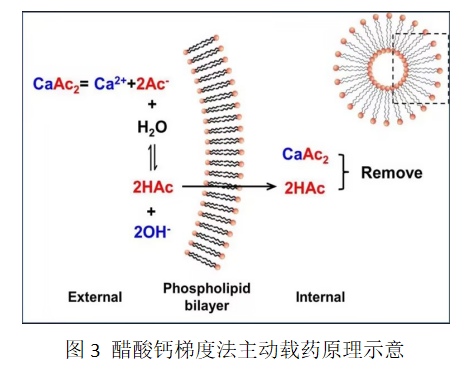
醋酸钙梯度法(Calcium acetate gradient method)的原理类似于硫酸铵梯度法。在制备过程中,以醋酸钙制备空白脂质体,再通过透析、滤、离子交换等方法将外水相中的醋酸钙除去,形成跨膜醋酸钙浓度梯度,通过醋酸钙电离和水解,促使大量醋酸分子(HAc)从浓度较高脂质体内水相扩散至浓度较低的外水相,该过程导致HAc携带大量质子从脂质体的内部转运到外部产生,在脂质膜两侧形成“内碱外酸”的跨膜梯度。而Ca2+几乎不能穿越磷脂双分子层,而保留在脂质体内部。这样的环境为装载和聚集弱酸性药物提供了高效的驱动力,弱酸性药物进入脂质体后形成离子并累积在内水相中。
当然,影响主动载药的因素很多,包括跨膜pH梯度、合适的孵育时间和孵育温度、合适的外水相pH调节剂、控制内水相缓冲能力、调整类脂的组成和比例等等。相信随着脂质体主动载药技术的成熟,更多并且更好的主动载药技术必将成为脂质体载药的主要方法。

ZSQ20231107