浙江微流纳米生物技术有限公司
自20世纪40年代青霉素问世以来,抗生素成为治疗细菌感染不可缺少的药物。然而,近几十年来,抗生素在临床、农业和动物生产环境中被过度使用,大量耐药细菌随之出现,最终抗生素耐药性导致了全球健康问题的加剧,成为了21世纪全球公共卫生面临的最大威胁之一。然而新的抗生素、生物制剂或辅助疗法的研究和开发是一个费时的过程,无法跟上日益增长的耐药率。因此,研究者把目光转向利用制剂学手段,将已上市批准的抗生素与脂质体结合起来,通过改进现有抗生素的体内行为,进一步改善其抗菌效果。脂质体在20世纪70年代作为药物载体被引入制剂处方,是一种很有前途的多功能药物囊泡,具有良好的生物相容性和可修饰性,其作为抗生素载体能降低药物毒性、改善药物生物学分布和药代动力学特性,并能延缓或避免细菌耐药和降低毒副作用。
1 脂质体概述
1.1 脂质体的简介
脂质体是一种自组装的磷脂质药物囊泡,由一个或多个磷脂双分子层围绕水腔室或单元组成的小球形囊泡。脂质体最初是于1965年由英国学者 Bangham和Standish发起的,并于20世纪70年代,Gregoriadis等首先将脂质体作为药物载体应用。此后,脂质体作为小分子药物、蛋白质、核酸和显像剂的递送载体被广泛研究。不同的给药途径,如肠外给药、肺给药、口服给药、经皮给药、眼给药和鼻给药,已经被开发出来,以提高治疗效果和患者的依从性。此外,脂质体在食品、化妆品等领域也得到了广泛的应用。
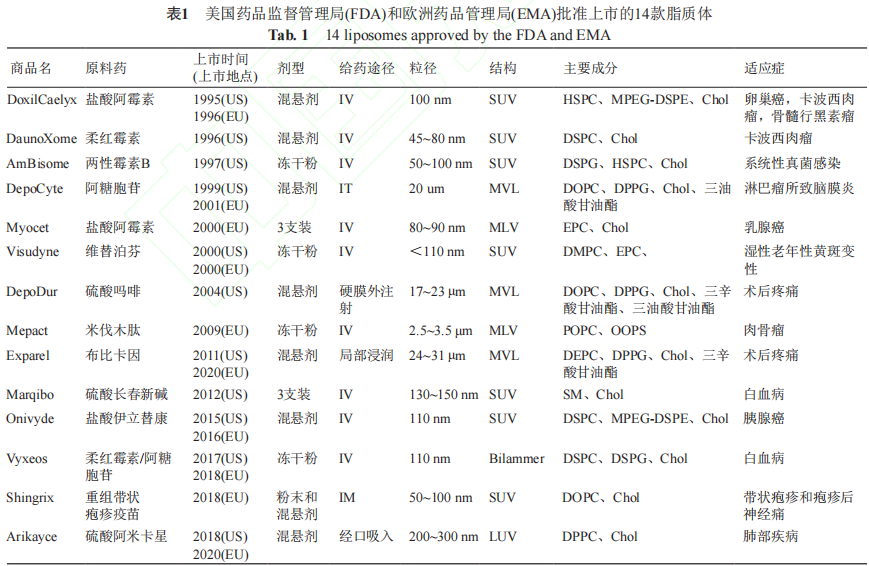
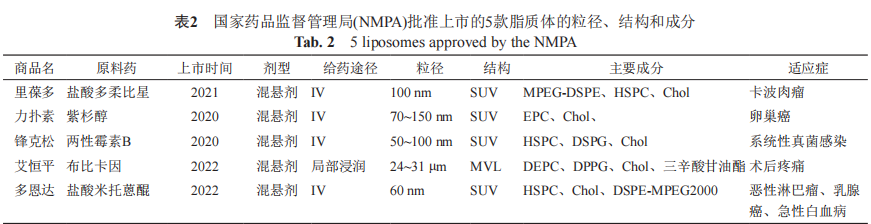
脂质体作为药物载体,可以保护被包被物质不被生理降解、提高药物稳定性、延长药物半衰期、具有良好的生物相容性和安全性等特性。此外, 脂质体可以通过被动或主动靶向选择性地将药物递送到病变部位,从而减少全身副作用,提高最大 耐受剂量,提高治疗效果。目前,国内外已有数个脂质体产品上市(表1~2),这些脂质体产品除主要集中于肿瘤治疗外也涉及感染、麻醉、疫苗、肺部疾病和光动力治疗等领域,剂型主要为无菌混悬液和冻干粉,给药途径包括静脉输注、肌内和鞘 内注射、硬膜外给药、局部浸润和口服吸入等。
1.2 脂质体的结构和性质
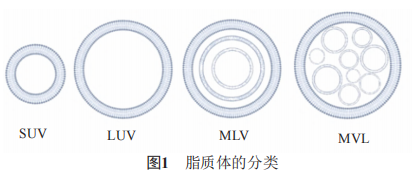
脂质体的结构是单层或多层球形囊泡,由一个或多个同心弯曲脂质双层膜和胆固醇组成,它们的 尺寸范围从二十纳米到几微米,根据其结构中的双层磷脂膜层数可分为单室脂质体(ULV)、多室脂质体 (MLV)和多囊脂质体(MVL)(图1)。根据颗粒大小,ULV 可进一步分为小单室脂质体(SUV,粒径约20~80nm)、 大单室脂质体(LUV,粒径在0.1~lμm),目前的商业产品多为SUV;MLV是由多层双分子层组成的泡囊,粒径在1~5μm之间,与MLV不同,MVL包括数百个由单层脂质膜包围的非同心水室,并呈现蜂窝状结构,粒径在10μm以上。
脂质体的特征取决于其磷脂组成、粒径、片层数、内/外水相、双分子层的电荷(阴离子、阳离子或中性)和聚合物或配体的表面功能化。这些特性会影响它们在体内外的稳定性和生物学性能,其中电荷和磷脂组成成分是特别重要的特征,它们决定着脂质体膜的流动性和稳定性,并影响脂质体—细菌的相互作用。此外,配体的表面功能化是将脂质体提升为潜在的破坏性抗菌疗法的一个基本特征, 如聚合物(如聚乙二醇化脂质体)和分子(如抗体、蛋白质/多肽和碳水化合物)用于特异性靶向脂质体,在高效递送和治疗效果中发挥着重要作用。
1.3 脂质体的制备
脂质体的制备方法分为被动载药法和主动载药法,其中被动载药法包括:薄膜水合法、冷冻干燥法、超声分散法、注入法、复乳法、反向蒸发法、 超临界法等;主动载药法为pH值梯度法、硫酸铵梯度法、醋酸钙梯度法等。不同方法的优缺点如下。
1.3.1 薄膜水合法
该方法通过去除有机溶剂,在圆底烧瓶中形成薄的脂质膜,加入分散介质并搅拌,形成非均质脂质体,该方法设备简单、较为成熟,适用于制备粒径在1~5μm的多层脂质体,但该方法制备出来的脂质体粒径大小很不均匀,且制备过程中使用了氯 仿和甲醇等有机试剂,会导致有机溶剂残留从而造成潜在毒性等问题。现常与其他制备方法相结合, 如薄膜-均质法、薄膜-挤压法、薄膜-超声法等。
1.3.2 注入法
注入法是将磷脂和胆固醇溶解在乙醇或乙醚中制成有机相,在磁力搅拌下将有机相注入一定体积的水相中,当有机溶剂和水相接触时脂质体因其避水作用而自发形成,最后通过旋转蒸发去除脂质体中的有机溶剂。该法的优点在于不需要通过超声或高压均质就能制备粒径很小的脂质体,通常用于制备30~200nm的单层脂质体,但其除去有机溶剂的温度较高,不适用于对热敏感的药物,且制备过程中使用多种有机溶剂也存在溶剂残留等问题。
1.3.3 冷冻干燥法
此法的特点是制备的脂质体粒径较小,通常小于200nm,且产品为粉末状物质,稳定性好,易于灭菌和贮存,因此常与其他制备方法合用以增加脂质体制剂的稳定性。但冷冻干燥法成本高、脂质体复水化后粒径分布不够均匀。
1.3.4 复乳法
复乳法是制备多囊脂质体的常用方法,适用于制备5~50μm的多囊脂质体,适合包封大分子水溶性药物,但该方法的包封率低。在乳化过程和有机溶剂的去除过程中,温度对脂质体的粒径有比较大的影响,较低的温度有利于减小脂质体的粒径,通过控制温度可以制得粒径为400nm, 包封率达到90%的脂质体。
1.3.5 超临界法
与传统方法不同,超临界法可以实现快速和简单的一步制备过程,并更好地控制所产生的脂质体的物理化学性质。此外,考虑到超临界流体的性质,有机溶剂的使用可以减少或完全避免。该方法应用广泛、粒径均一、步骤简单、包封率高、稳定性强,适用于工业《药品生产质量管理规范》 (GMP)工艺,但技术条件要求苛刻。
1.3.6 逆相蒸发法
逆相蒸发法制备的脂质体内水相体积大,适合包裹水溶性的大分子活性物质,如蛋白质、抗生素、核酸,但包封的物质接触有机溶剂,会导致蛋白质变性。逆相蒸发法的包封率明显高于薄膜分散- 超声法,而逆相蒸发法制备所得脂质体的粒径比薄膜分散-超声法制备脂质体的粒径大,因此逆相蒸发法更适合水溶性药物。
1.3.7 主动载药法
适用于水溶性、两亲性药物的包裹,包封率高。但操作过程烦琐,需透析除盐等步骤。硫酸铵梯度法与pH梯度法相比无须缓冲液或pH滴定,操作简便,内水相只在短时间内呈较低pH,有利于脂质体的稳定性。有研究表明,分别采用pH梯度法与硫酸铵梯度法,以相同的脂质及组成制备多柔比星脂质体,后法所得脂质体的稳定性高于前者, 前法所得脂质体在贮存期间易渗漏。
2 脂质体作为抗生素载体的优势
脂质体作为抗生素载体,能显著改善药物在组织内的分布,有效提高抗炎部位抗生素的局部浓度,并抑制细菌诱导耐药性的产生,也可以克服细菌的部分耐药性,有利于减少全身给药剂量,降低毒副作用;此外,脂质体可以被生物降解,无体内残留风险,是经典的抗生素药物递送载体之一。 与普通化学药物相比,抗生素类脂质体药物制剂还有以下方面的优势。
2.1 稳定性
2.1.1 控制抗生素的持续释放
一些研究表明,对于一些具有浓度依赖性活性的药物,例如氟喹诺酮类药物和氨基糖苷类药物等,需要使用较高剂量的抗生素才能有效地清除和防止耐药菌株的选择。因此,当使用游离药物时, 为了保持抗生素浓度高于细菌最低抑制浓度(MIC), 高剂量和重复给药是必不可少的,而高浓度抗生素的使用受到抗生素剂量依赖性毒性作用的限制, 这使得抗生素治疗剂量的管理成为临床挑战。
在抗生素中加入脂质体可调节被包裹抗生素的释放。根据脂质体的组成和特定刺激因素(如pH值或热量)的存在,脂质体可被设计成以可控的方式分解 并随后释放包裹的药物。抗生素的持续释放能够维持高于MIC浓度水平,却不会产生二次毒性,因此对抗生素耐药菌株非常有效,其在感染部位的循环过程中会持续一段时间,从而降低给药频率以及全身毒性。
2.1.2 延长血浆循环时间
对于一些杀菌活性较慢的抗生素,如β-内酰胺类和万古霉素,它们的抗菌作用具有高度的时间依赖性。此外,β-内酰胺类抗生素还具有与血清蛋白结合的特性,可影响血浆中游离抗生素浓度,降低抗菌活性。因此,为了保持抗生素的血药浓度在 治疗水平,需要频繁给药。在脂质体中包裹抗生素可以有效增加药物在体内循环时间,在不需要重复给药或高剂量给药浓度 的情况下获得更好的抗菌效果,此外,还可以防止不必要的酶降解和化学或免疫失活。
2.2 对感染部位具有特定的靶向性
脂质体以静脉方式给药时,能选择性地集中于网状内皮系统,定向到特定部位,如选择性组织、器官或致病菌,这是脂质体作为抗生素输送载体最大特征之一。对于特定类型的感染,如呼吸道感染,可以设计脂质体气雾剂进行抗菌治疗,特别是对肺透性差的抗生素,如β-内酰胺类、黏菌素、氨基糖苷类和糖肽。
2.3 抑制细菌的部分耐药性
由于脂质体结构和组成与细菌膜相似,因此脂质体能够通过与细菌外膜发生融合,将抗生素释放到细菌周质中,与游离形式的抗生素相比,抗生素负载脂质体后增强了抗菌活性,并破坏细菌的耐药机制。
3 抗生素脂质体存在的问题
3.1 稳定性差
抗生素脂质体的主要缺点是脂质囊泡的保质期较短,这主要受到脂质体物理和化学过程的制约。 化学不稳定性主要是由于酯键的水解或用于构建脂质体囊泡的脂质的不饱和酰基链的氧化所造成,而天然来源的磷脂在其酰基链上所表现出的结构多样 性也会导致脂质体稳定性的差异。因此,脂质体药物在体外的稳定性主要取决于脂质组成和储存温度,可以通过添加抗氧化剂成分或冷冻干燥以防止氧化,也可以在较低温度下储存脂质体抗生素以阻止其水解。脂质体物理稳定性主要包括粒径、粒度分布和包封药物的泄漏等,物理稳定性差会导致药物的渗漏率增加。脂质体的物理稳定性可通过添加胆固醇、进一步增加脂质体膜材的稳定性以及对脂质体表面进行修饰等方法来提高。
3.2 包封率偏低
包封率对脂质体药物的治疗效用具有非常重要的影响,是评价脂质体药物质量的最重要因素,脂质体只有在包封率达到一定要求,并在体外释放药 物达药物治疗浓度时才能得到进一步应用。高剂量的脂质可能是有毒的,并且会影响脂质体药物的药代动力学。由于脂质体制剂中存在残留的有毒有机溶剂,通常不适合一些采用有机溶剂的高效封装方法。低包封率也会使药物和脂质体膜材质量增加, 从而大大增加药品成本。通过对脂质体制备工艺及处方进行优化和筛选,在一定程度上可以提高抗生素脂质体的包封率。
3.3 其他
目前脂质体药物的制备方法非常复杂和昂贵,难以应用到工业化生产中。一方面,有些制备方法仅适合进行实验研究,所以工业化生产也是脂质体技术需迫切解决的问题。另一方面,脂质体抗生素制备的一个非常重要的因素是无菌性,由于脂质对高温非常敏感,且很容易被氧化和水解,因此许多脂质体抗生素的灭菌程序不能涉及使用加热、辐照或化学制剂,热杀菌只能考虑耐热和亲热药物, 机械过滤仅适用于比细菌细胞更小的抗生素脂质体,而且仍然不能保证去除病毒颗粒。
4 总结
近年来,由于抗生素耐药性病原体的出现,现代医学正面临着治疗细菌感染的重大挑战。为解决这一问题,人们广泛研究开发新的抗生素递送策略以提高其抗菌效果,其中脂质体被认为是最有前途的药物递送系统之一。一方面,它们能够改进药物的药代动力学和药效学;另一方面,它们也能够保护被包裹的药物免受过早的酶促和免疫失活, 并以有效和持续的方式将抗生素直接输送至感染部位、组织或病原体,限制其分布到健康组织,并最大限度地减少可能的毒副作用。此外,脂质体脂质双分子层可能与细菌细胞膜直接相互作用或融合,增加细菌内的抗生素浓度,从而有助于改善抗生素的治疗效果,脂质体包裹的抗生素已被证明可以克服某些微生物耐药机制,如不渗透的外膜、外排机制和酶降解。最后,需要更好地理解抗生素 脂质体和细菌细胞之间的机制,从而进一步优化这些抗生素传递系统。

CHEN240628M